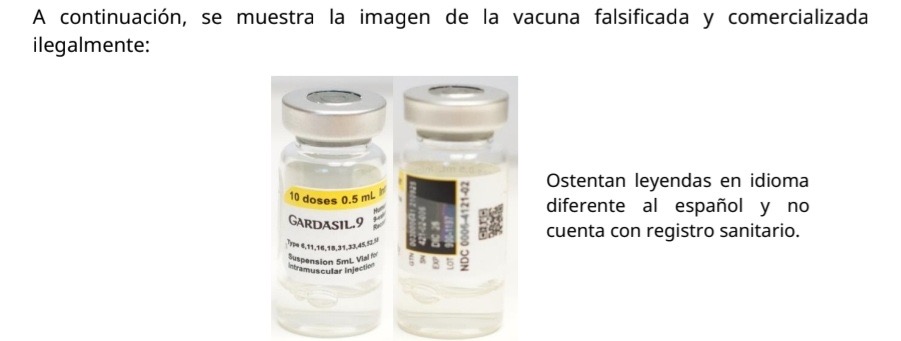
La Secretaría de Salud (SESA) del estado de Querétaro informa que la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS), emite Alerta Sanitaria para los profesionales de la salud y a la población en general, sobre la falsificación y comercialización ilegal de GARDASIL. 9, 10 doses (0.5 mL) (vacuna recombinante nonavalente contra el virus de papiloma humano), suspensión intramuscular.
Esta alerta se emite a partir de las acciones de control sanitario, así como de la comparecencia que sostuvo MERCK SHARP & DOHME COMERCIALIZADORA, S. DE R.L. DE C.V., ante COFEPRIS y de la empresa responsable de la importación, almacenamiento y distribución en México, del producto con denominación distintiva GARDASIL 9, una dosis, la cual es diferente a la de la vacuna falsificada y comercializada ilegalmente.
Bajo ese contexto, dicha empresa manifestó la falsificación y comercialización ilegal del producto GARDASIL. 9, 10 doses (0.5 mL), con los siguientes números de lote:
· 900-1197-NDC 0006-4121-02, fecha de caducidad DIC 25, presenta las siguientes anomalías: No corresponde con la presentación autorizada por esta comisión federal y tampoco es reconocido como importado y distribuido por MERCK SHARP & DOHME COMERCIALIZADORA, S. DE R.L. DE C.V., ni fabricado por Merck Sharp & Dohme B.V.
· 900-1147, fecha de caducidad JUL 25, presenta las siguientes anomalías: No corresponde con la presentación autorizada por esta comisión federal y tampoco es reconocido como importado y distribuido por MERCK SHARP & DOHME COMERCIALIZADORA, S. DE R.L. DE C.V., ni fabricado por Merck Sharp & Dohme B.V.
· 900-1227, fecha de caducidad FEB 26, presenta las siguientes anomalías: No corresponde con la presentación autorizada por esta comisión federal y tampoco es reconocido como importado y distribuido por MERCK SHARP & DOHME COMERCIALIZADORA, S. DE R.L. DE C.V., ni fabricado por Merck Sharp & Dohme B.V.
La imagen de la vacuna falsificada y comercializada ilegalmente: Ostenta leyendas en idioma diferente al español y no cuenta con registro sanitario.
Al tratarse de productos que no cuentan con autorización para su comercialización en México, este producto representa un riesgo a la salud de la población ya que se desconoce su procedencia, condiciones de fabricación, almacenamiento y transporte, así como las materias primas con las que fue elaborado, por lo que no se garantiza la seguridad, eficacia y calidad de este.
Por lo anterior, COFEPRIS emite las siguientes recomendaciones:
A la población en general:
· Suspender el uso y administración de la vacuna GARDASIL. 9, 10 doses (0.5 mL), con cualquier número de lote y fecha de caducidad.
· No suministrar vacunas que ostenten idioma diferente al español y que no cuente con registro sanitario.
· Antes de suministrar esta o cualquier vacuna, siempre realizar una inspección visual del empaque secundario y primario para verificar que los números de lote y fechas de caducidad concuerden, así como al contenido para revisar que no presente alguna anomalía.
· Si se ha suministrado la vacuna GARDASIL. 9, 10 doses (0.5 mL) y ha presentado cualquier reacción adversa o malestar, reportarlo al correo electrónico: [email protected]
Profesionales de la salud:
· No adquirir, ni suministrar la vacuna GARDASIL. 9, 10 doses (0.5 mL), con cualquier número de lote y fecha de caducidad.
· En caso de identificar la venta de la vacuna GARDASIL. 9, 10 doses (0.5 mL), con las características antes mencionadas, no adquirirlo y de contar con información sobre su posible comercialización, realizar la denuncia sanitaria correspondiente.
· Siempre adquirir vacunas con distribuidores autorizados y validados por la empresa titular del registro sanitario, mismos que deberán contar con licencia sanitaria y aviso de funcionamiento; de igual forma, contar con la documentación de la legal adquisición del producto.
· Se recomienda consultar el Listado de Distribuidores Irregulares emitido por COFEPRIS, previo a la adquisición de productos.
Distribuidores y farmacias:
· Adquirir vacunas solo en los establecimientos formalmente constituidos, que cuenten con licencia sanitaria y aviso de funcionamiento.
· Adquirir y comercializar vacunas, que ostenten idioma al español, además que deberán contar con la documentación que garanticen la calidad y seguridad de las vacunas.
· Garantizar las condiciones de almacenamiento y transporte para que el producto no represente un riesgo sanitario.